近日,华南师范大学环境学院李晓敏教授课题组,与广东省科学院生态环境与土壤研究所李芳柏研究员团队合作,在微生物驱动的硝酸盐还原-亚铁氧化耦合过程的机制与环境效应方面取得新进展。相关成果已发表在环境科学领域权威期刊Environmental Science & Technology (2023, 57, 21156–21167)和Science of the Total Environment (2024, 912, 168720)上。
研究背景
微生物驱动的硝酸盐还原-亚铁氧化过程(Nitrate reducing Fe(II) oxidation, NRFO)自1996年首次被报道后备受关注(Straub et al., 1996; Bryce et al., 2018)。该过程在铁、氮元素生物地球化学循环过程中具有重要作用,而且强烈影响N2O等温室气体的排放,亚铁氧化形成的次生矿物还能够影响碳的固定以及重金属等污染物的迁移转化(Li et al., 2016; Chen et al., 2022; Song et al., 2022; Huang et al., 2023)。在NRFO过程中,硝酸盐还原的中间产物亚硝酸盐,能够与亚铁发生化学反硝化作用(Chemodenitrification),并在微生物的胞外与胞内生成次生矿物,导致细胞结壳(Cell encrustation)。
科学问题
(1) 自然环境中存在大量可驱动NRFO过程的微生物,以硝酸盐还原菌为主,可通过反硝化(Denitrification)和异化硝酸盐还原成铵(Dissimilatory nitrate reduction to ammonium, DNRA)两个途径还原硝酸盐。然而,NRFO过程中亚铁氧化引起的细胞结壳,如何影响反硝化和异化硝酸盐还原成铵这两个过程及其功能基因和功能微生物,尚未明确。
(2) 已有报道表明,Acidovorax sp. BoFeN1和Pseudogulbenkiania sp. 2002等NRFO菌的外膜和胞外聚合物中含有c型细胞色素(c-type cytochrome),可在中性厌氧条件下直接介导生物亚铁氧化(Liu et al., 2019)。然而,生物亚铁氧化具体与反硝化过程中的哪个步骤发生耦合,仍不清楚。
研究内容与意义
为了回答上述科学问题,研究团队开展了以下研究内容:
(1) 采集来自广东台山沉积物发育、广西隆安石灰岩发育的两种不同母质的稻田土壤,设置Soil+Fe(II)、Soil+NO3−、Soil+Fe(II)+NO3−等三个处理开展厌氧传代培养实验。当传代至第三轮培养时亚铁氧化与硝酸盐还原动力学结果基本趋于稳定,进而测试体系中溶解态Fe(II)和盐酸提取态Fe(III)等铁物种,以及NO3−、NO2−、N2O、NH4+等氮物种的动态变化,并运用宏基因组学定量分析不同处理中参与Denitrification和DNRA过程的相关功能基因和功能微生物的变化。
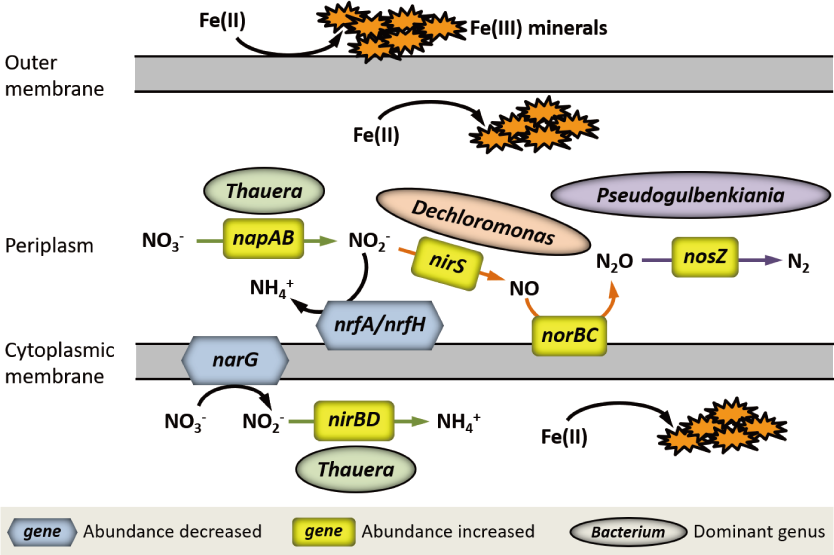
我们发现,亚铁的存在减慢了微生物还原硝酸盐的速率,但提高了亚硝酸盐的累积量,这是由快速的亚铁氧化及其在细胞周质和细胞表面产生的次生矿物结壳导致的。在本研究体系中,不管亚铁是否存在,硝酸盐还原产物中N2O和NH4+所占的比例较低,培养结束时仅为3.25%∼6.51%;而亚铁的存在能够减少N2O的积累。两种不同母质发育的土壤在Soil+NO3−处理中分别富集了不同组成的优势微生物;但是在Soil+Fe(II)+NO3−处理中却富集了相同组成的优势微生物,主要包括Dechloromonas、Azospira和Pseudomonas等。与Soil+NO3−处理相比,Soil+Fe(II)+NO3−处理提高了napAB、nirS、norBC、nosZ和nirBD基因的相对丰度,但降低了narG和nrfA基因的相对丰度,这表明亚铁氧化有利于周质的硝酸盐还原过程和胞质内的亚硝酸盐还原产氨过程。在Soil+Fe(II)+NO3−处理中,Dechloromonas主导亚硝酸盐还原成N2O的过程;Thauera主导周质的硝酸盐还原过程和胞质内亚硝酸盐还原产氨过程;Pseudogulbenkiania主导N2O还原产氮气的过程。然而,由于Thauera和Pseudogulbenkiania的相对丰度远低于Dechloromonas等优势微生物,因此减慢了硝酸盐还原速率,也限制了NH4+和氮气的生成。
虽然硝酸盐还原-亚铁氧化过程有可能通过细胞结壳导致细菌失活或死亡,但是来自不同母质发育土壤的Dechloromonas、Pseudogulbenkiania、Azospira、Pseudomonas和Thauera等微生物能够在多次传代培养后存活与富集,表明其对细胞结壳具有强的适应性和抗性。因此,未来可开发相关的微生物菌剂,用于激发厌氧环境的NRFO过程,进而实现碳、氮、重金属等固碳减排的目的。
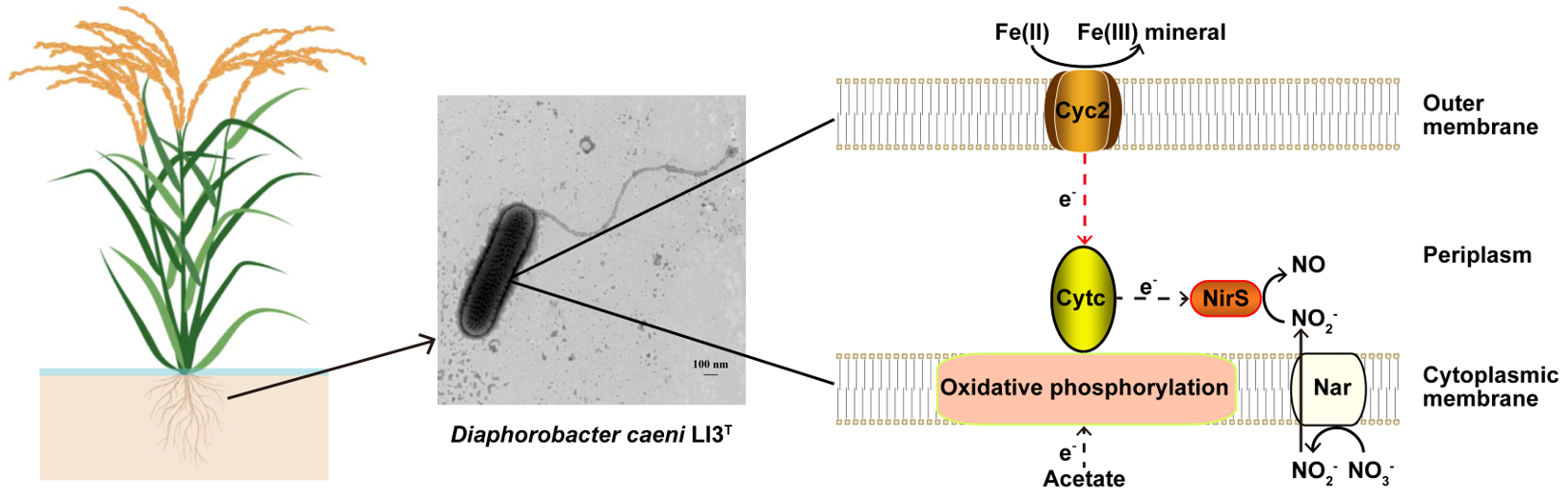
(2) 从华南红壤区水稻土中分离出一株硝酸盐还原-亚铁氧化菌Diaphorobacter caeni LI3,分别以NO3−或NO2−为电子受体设置含/不含Cell和Fe(II)的处理,测试不同处理中亚铁氧化、硝酸盐/亚硝酸盐还原、N2O生成、碳源利用、细胞生长、氮同位素分馏(δ15N-N2O)等动态变化,并通过分析全基因组和构建蛋白互作网络(PPI)探讨该菌驱动的硝酸盐还原-亚铁氧化耦合机制。
我们发现,在Cell+NO3−+Fe(II)、Cell+NO2−+Fe(II)和NO2−+Fe(II)三个处理中均可发生厌氧亚铁氧化,并在细胞表面和周质生成无定型氧化铁和纤铁矿(lepidocrocite)。亚铁的存在轻微地加速了LI3菌株还原硝酸盐的速率;但是减慢了LI3菌株还原亚硝酸盐的速率,这很可能是由周质的细胞结壳导致。亚铁的存在抑制了LI3菌株对碳源乙酸的利用,但提高了细胞总蛋白的浓度,因此推测LI3菌株可通过乙酸代谢和亚铁氧化获得能量进而促进生长。Cell+NO3−+Fe(II)处理的δ15N-N2O值与Cell+NO3−和Cell+NO2−这两个处理的接近,表明该体系中N2O的生成主要来源于生物作用。在LI3菌株的全基因组中发现一套完整的反硝化基因,包括narG、nirS、norBC和nosZ;也含有氧化磷酸化基因,包括复合体I的nuo、复合体II的sdh、复合体III的pet、复合体IV的cco、cyo、cox,以及复合体V的atp;在亚铁氧化方面,还检测到编码外膜蛋白的cyc2基因和编码周质蛋白的cytc基因。通过蛋白互作网络分析推测,在LI3菌株中,除了乙酸代谢通过氧化磷酸化与亚硝酸盐还原发生耦合这一途径以外,亚铁氧化还可能通过Cyc2-Cytc-NirS的电子传递路径进行耦合。
前人通过构建基于亚铁和硝酸盐/亚硝酸盐的动力学模型、N-O同位素分馏等方法,定量评估了生物作用和化学反硝化作用在Acidovorax sp. BoFeN1和Pseudogulbenkiania sp. 2002等菌株驱动的NRFO过程中的相对贡献(Liu et al., 2019; Visser et al., 2022; Chen et al., 2023)。由于Diaphorobacter caeni LI3在系统发育树上与Acidovorax菌属具有较近的同源性,本研究推测的亚铁氧化与硝酸盐还原的潜在耦合途径,还需要通过转录组、蛋白组,以及对比基因组等方法,在LI3菌株和其他典型的NRFO菌株中进行进一步的验证。
原文链接:
(1) Pan Dandan#, Chen Pengcheng#, Yang Guang, Niu Rumiao, Bai Yab, Cheng Kuan, Huang Guoyong, Liu Tongxu, Li Xiaomin*, Li Fangbai. (2023) Fe(II) oxidation shaped functional genes and bacteria involved in denitrification and dissimilatory nitrate reduction to ammonium from different paddy soils. Environmental Science & Technology 57 (50), 21156–21167. https://url.scnu.edu.cn/record/view/index.html?key=e98bc33e6e842f1494b2d908de4c2801
(2) Yang Guang#, Li Shuang#, Niu Rumiao, Hu Min, Huang Guoyong, Pan Dandan, Yan Siyao, Liu Tongxu, Li Xiaomin*, Li Fangbai. (2024) Insights into nitrate-reducing Fe(II) oxidation by Diaphorobacter caeni LI3T through kinetic, nitrogen isotope fractionation, and genome analyses. Science of the Total Environment 912, 168720. https://url.scnu.edu.cn/record/view/index.html?key=afffb0a79ec6a1f1b45c244a2eeef028
相关文献:
[1] Straub KL, Benz M, Schink B, Widdel F. (1996) Anaerobic, nitrate-dependent microbial oxidation of ferrous iron. Applied and Environmental Microbiology 62 (4), 1458–1460. https://url.scnu.edu.cn/record/view/index.html?key=00fb14cebdab1aa0de2eb2195dcdef29
[2] Bryce C, Blackwell N, Schmidt C, Otte J, Huang YM, Kleindienst S, Tomaszewski E, Schad M, Warter V, Peng C, Byrne JM, Kappler A. (2018) Microbial anaerobic Fe(II) oxidation - Ecology, mechanisms and environmental implications. Environmental Microbiology 20 (10), 3462−3483. https://url.scnu.edu.cn/record/view/index.html?key=87c7ad12b79e7c056b8901e30488b64d
[3] Li XM, Zhang W, Liu TX, Chen LX, Chen PC, Li FB. (2016) Changes in the composition and diversity of microbial communities during anaerobic nitrate reduction and Fe(II) oxidation at circumneutral pH in paddy soil. Soil Biology & Biochemistry 94, 70–79. https://url.scnu.edu.cn/record/view/index.html?key=402b72ca0248d0ad67e28a7f5d53e9ae
[4] Chen YT, Li XM, Liu TX, Li FB, Sun WM, Young LY, Huang WL. (2022) Metagenomic analysis of Fe(II)-oxidizing bacteria for Fe(III) mineral formation and carbon assimilation under microoxic conditions in paddy soil. Science of the Total Environment 851, 158068. https://url.scnu.edu.cn/record/view/index.html?key=79e0ad87a03079998b4484114ff9437a
[5] Song XX, Wang P, Zwieten LV, Bolan N, Wang HL, Li XM, Cheng K, Yang Y, Wang ML, Liu TX, Li FB. (2022) Towards a better understanding of the role of Fe cycling in soil for carbon stabilization and degradation. Carbon Research 1, 5.https://url.scnu.edu.cn/record/view/index.html?key=29c13be814447e1bd936d27c2c019d18
[6] Huang GY, Wang XN, Pan DD, Yang G, Zhong RL, Niu RM, Xia BQ, Cheng K, Liu TX, Li XM. (2023) Cadmium immobilization during nitrate-reducing Fe(II) oxidation by Acidovorax sp. BoFeN1: Contribution of bacterial cells and secondary minerals. Chemical Geology 639, 121729. https://url.scnu.edu.cn/record/view/index.html?key=0282fbc31d27bcbb1cfe2de7c3ca717f
[7] Liu TX, Chen DD, Luo XB, Li XM, Li FB. (2019) Microbially mediated nitrate-reducing Fe(II) oxidation: Quantification of chemodenitrification and biological reactions. Geochimica et Cosmochimica Acta 256, 97−115. https://url.scnu.edu.cn/record/view/index.html?key=b6774b65138b3cb539a927dfb20562f3
[8] Visser AN, Wankel SD, Frey C, Kappler A, Lehmann MF. (2022) Unchanged nitrate and nitrite isotope fractionation during heterotrophic and Fe(II)-mixotrophic denitrification suggest a non-enzymatic link between denitrification and Fe(II) oxidation. Frontier in Microbiology 13, 927475. https://url.scnu.edu.cn/record/view/index.html?key=b4bb5fc57652a50ec64e8216afc7b16a
[9] Chen DD, Cheng K, Liu TX, Chen GJ, Kappler A, Li XM, Zeng RJX, Yang Y, Yue FJ, Hu SW, Cao F, Li FB. (2023) Novel insight into microbially mediated nitrate-reducing Fe(II) oxidation by Acidovorax sp. strain BoFeN1 using dual N-O isotope fractionation. Environmental Science & Technology 57 (33), 12546–12555. https://url.scnu.edu.cn/record/view/index.html?key=2e6ff13e298859b1639ef2c871c4a289